急性骨髄性白血病の治療
Q.急性骨髄性白血病(AML)ではどのような治療が行われるのですか
A.まずは複数の抗がん剤を組み合わせた薬物療法によって白血病細胞をできる限り減らす寛解導入療法を行います。治療方針は、年齢、全身状態、他の持病の有無、 染色体・遺伝子異常の有無や種類、本人の希望などによって異なります。
AMLでは、まず寛解導入療法を行い、完全寛解を目指します。治療は、日本血液学会やNCCN(世界の主要ながんセンターの同盟団体)、ESMO(欧州臨床腫瘍学会)が作成したガイドラインによって標準化されています。この標準化された治療法 (標準治療)は、現時点で最適な治療法です。
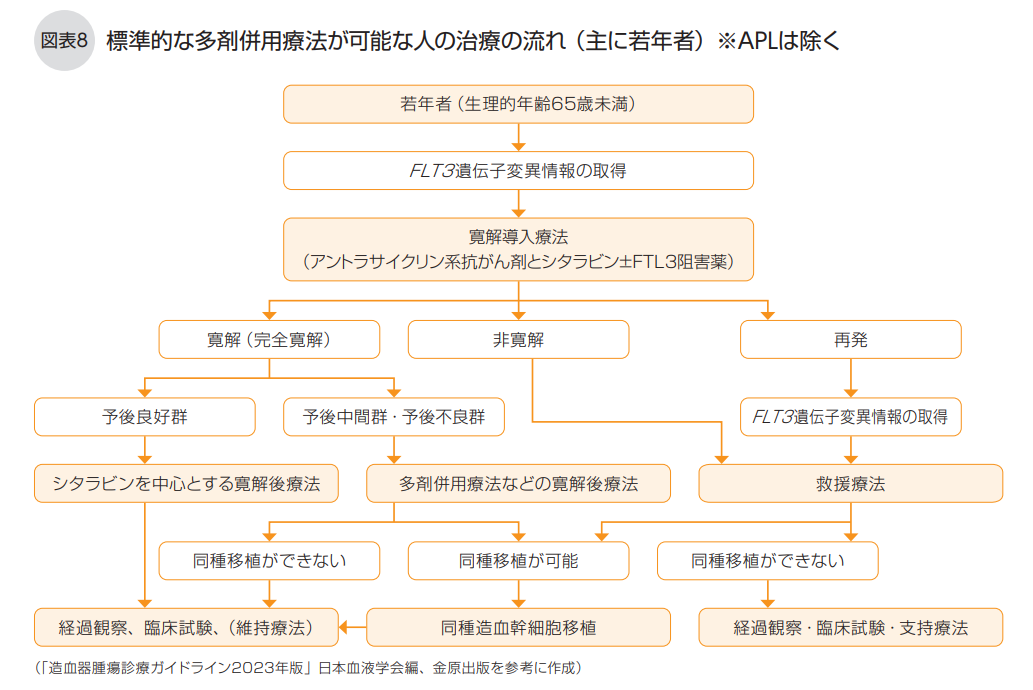
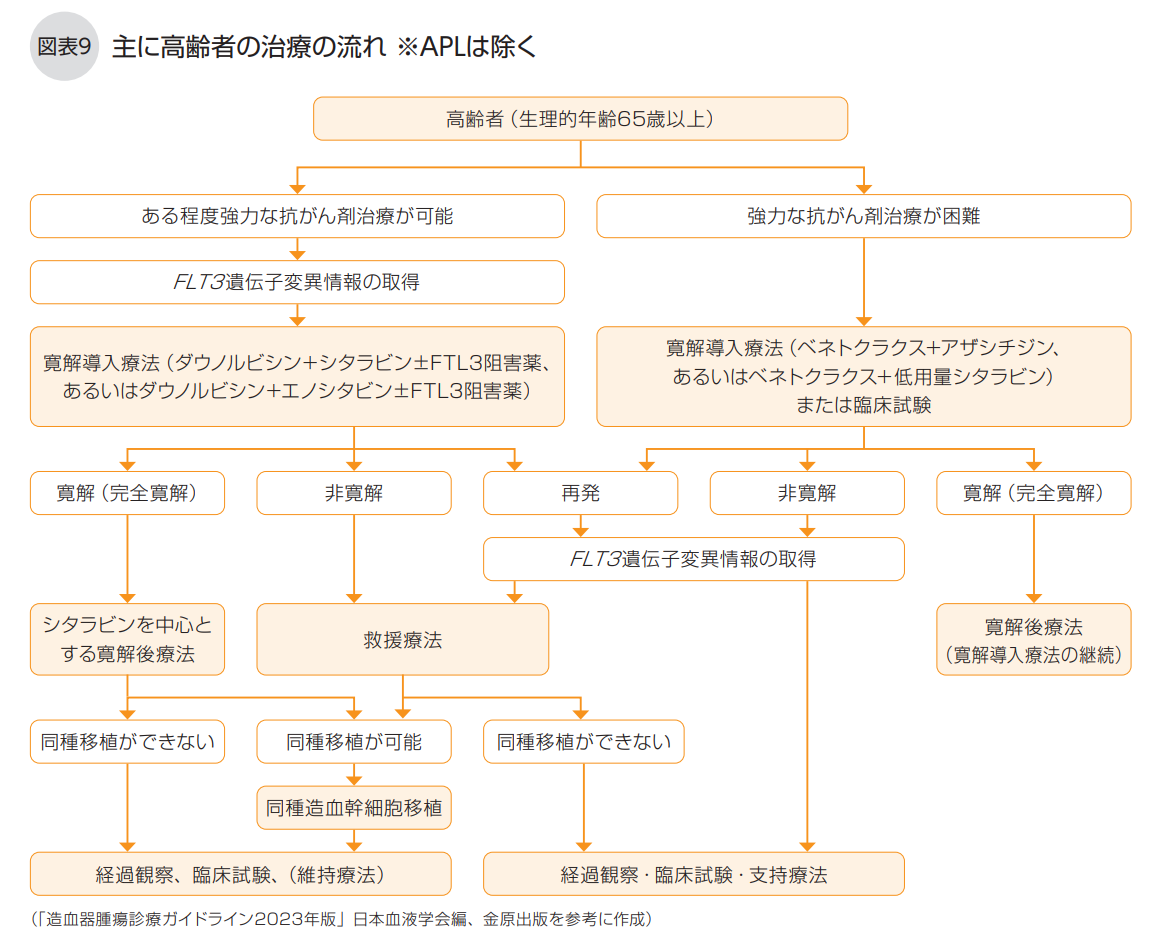
AMLは、標準的な多剤併用療法(殺細胞性の抗がん剤治療)が可能な場合(主に若年者)と、可能ではない場合(主に高齢者)で、 薬物療法の内容が異なります(図表8、9)。
標準的な多剤併用療法が可能かどうかは、年齢、心臓、肺、肝臓、腎臓の状態、全身状態、併存疾患の有無、本人の希望などを考慮し、総合的に判断されます(図表6)。日本ではおおむね65歳未満を「若年者」、65歳以上を「高齢者」としています。高齢者においては、予後因子と背景因子を考慮して、標準的な多剤併用療法あるいは分子標的薬による治療が選択されます。

◆標準的な多剤併用療法が可能な人の治療(APLは除く)
感染症になりやすく出血しやすい状態になっているので、AMLであることがわかったら、すぐに入院して寛解導入療法を開始します。
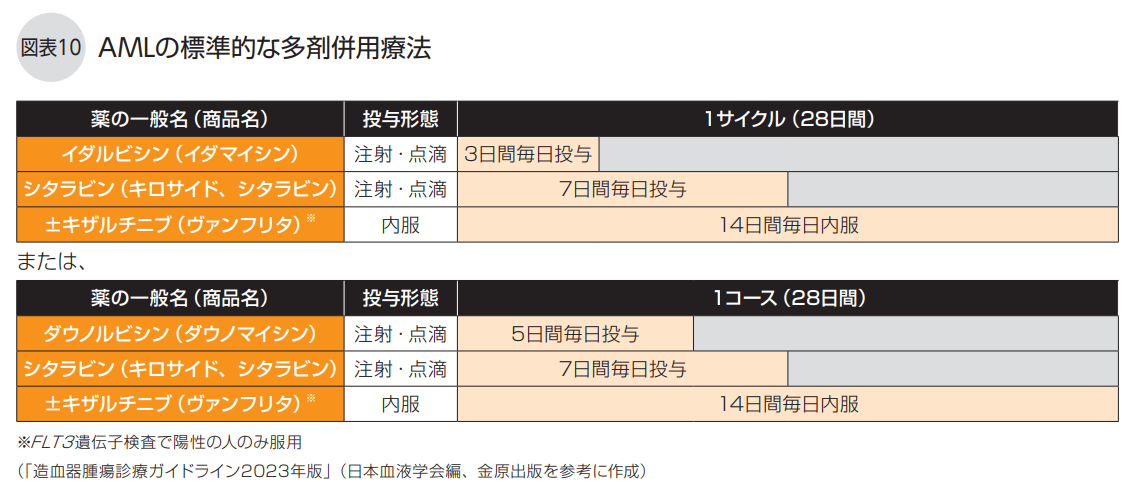
標準的な多剤併用療法が可能な人の寛解導入療法は、アントラサイクリン系抗がん剤のイダルビシン(商品名イダマイシン)または高用量ダウノルビシン(商品名ダウノマイシン)と標準量のシタラビン(AraC、商品名キロサイド、シタラビン)の併用療法です。イダルビシンを用いる場合はイダルビシン(12㎎/㎡)とシタラビン (100㎎/㎡)、ダウノルビシンを用いる場合にはダウノルビシン(50㎎/㎡)とシタラビン(100㎎/㎡) を併用して点滴投与します(図表10)。
日本成人白血病治療共同研究機構(JALSG)が実施したイダルビシンとシタラビンの併用療法とダウノルビシンとシタラビンの併用療法の比較試験では、完全寛解率、生存割合ともに同等で、差が出ませんでした。そのため、どちらも標準治療になっており、どちらを選ぶかは病院によって異なります。
骨髄異形成症候群の既往があるAML、治療関連AMLなど高リスクAMLの場合には、 ダウノルビシン・シタラビンリポソーム製剤 (商品名ビキセオス)も選択肢になります。ダウノルビシンとシタラビンをリポソームに封入し、骨髄に届くように加工された注射薬です。1日目、3日目、5日目に1回90分かけて点滴投与します。
また、標準的な多剤併用療法が可能な場合にはFLT3遺伝子検査を行い、陽性なら、内服薬のFLT3阻害薬キザルチニブ(商品名ヴァンフリタ)を1日1回35.4㎎併用します。 FLT3阻害薬は、白血病細胞の増殖に関わるFLT3というタンパク質の働きを邪魔することで、FLT3-ITD遺伝子変異のある白血病細胞の増殖を抑える分子標的薬です。FLT3遺伝子変異陽性かどうかは、骨髄液か末梢血を用いた遺伝子検査で調べます。FLT3遺伝子変異はAMLで最も多い遺伝子変異で、日本人のAML患者の約3割が陽性になります。 縦列重複配列(ITD)があるFLT3-ITD遺伝子変異では特に予後が悪い傾向がありますが、キザルチニブを寛解導入療法や寛解後療法に追加することで生存率の改善が期待できます。
標準的な寛解導入療法は1コースを28日間とし1~3コース程度、ダウノルビシン・ シタラビンリポソーム製剤の場合は最大2コース続けます。
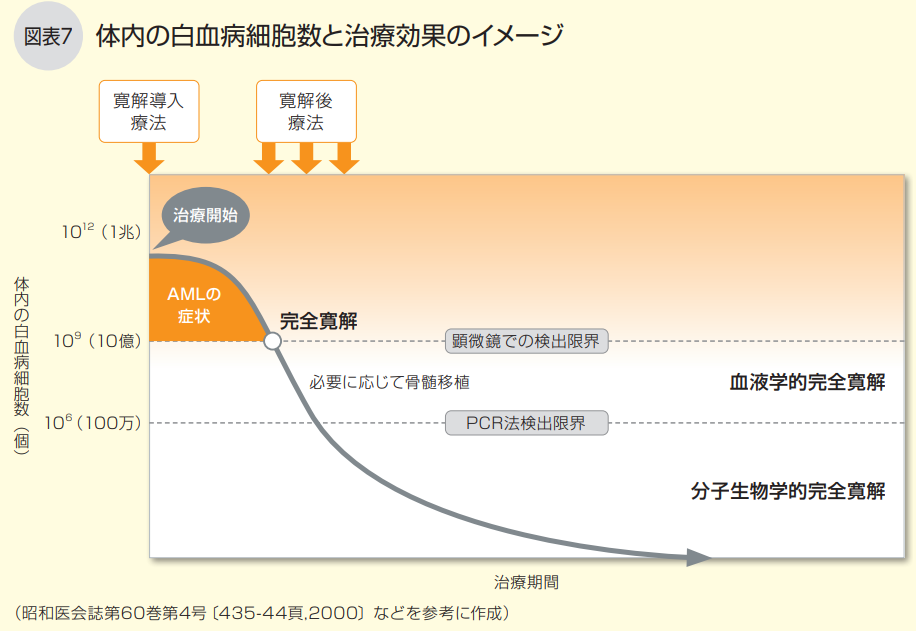
AMLの患者さんの体の中には、診断時には約1兆個以上の白血病細胞がありますが、寛解導入療法によって完全寛解が得られ、白血病細胞が10億個以下になると、骨髄中に正常な血液細胞が増え、倦怠感、発熱、息切れ、貧血などのつらい症状も改善します。
ただし、完全寛解が得られて、AMLによる症状が軽減しても、まだ体の中には白血病細胞が残っている状態です。そのため、寛解導入療法で完全寛解が得られた場合には寛解後療法(地固め療法)を行い、体の中に残存している白血病細胞を限りなくゼロに近い状態にすることを目指します(図表7)。
寛解後療法の内容は、「予後良好群」と「予後中間群・予後不良群」のどちらに当てはまるかで異なります(「急性骨髄性白血病の分類」図表5参照)。
白血病細胞の染色体異常と遺伝子異常が 「予後良好群」の寛解後療法は、シタラビン大量療法になります。シタラビン大量療法は、シタラビン(3g/㎡)を1日2回各3時間、1日目、3日目、5日目に点滴投与して1コースとし、これを3コース繰り返します。「予後良好群」に当てはまる人は、シタラビン大量療法で完全寛解を長期的に保てる可能性が高く、同種移植の有用性は現時点では証明されていません。
「予後中間群・予後不良群」なら、アントラサイクリン系抗がん剤とシタラビンの併用療法を4コース実施します。ダウノルビシン・シタラビンリポソーム製剤を用いる場合には、最後の寛解導入療法開始から5~8週間後に最大2コースまで点滴投与します。
染色体異常が「予後中間群・予後不良群」に当てはまる人は、造血幹細胞移植(同種移植)を受けたほうが生存率が高まることがわかっているため、可能ならば、同種移植を行います。同種移植が可能かどうかは、年齢、全身状態、他の持病の有無、臓器の状態、本人の希望などによって総合的に判断されます。
最初の寛解導入療法で完全寛解にならなかったときには、もう一度、同じ寛解導入療法を行うか、少し薬を変えた多剤併用の薬物療法(救援療法)を行い、再度完全寛解を目指します。
救援療法として分子標的薬や抗体薬が選択されることがあります。
救援療法では、FLT3遺伝子変異陽性なら、FLT3阻害薬のギルテリチニブ(商品名ゾスパタ)で治療することがあります。内服薬で、1日1回服用する薬です。
FLT3遺伝子変異陰性の場合は、ゲムツズマブオゾガマイシン(商品名マイロターグ) による抗体療法を行うこともあります。ゲムツズマブオゾガマイシンは、白血病細胞の表面のCD33抗原をターゲットにした抗体に、抗がん剤のカリケアマイシンを結合させた抗体薬で、CD33抗原という目印がある再発・ 難治性のAMLに有効です。1回2時間で点滴投与し、少なくとも14日以上間をあけて2回投与します。
完全寛解には種類がある
治療の目標は、白血病細胞をすべて殺すことです。まずは寛解導入療法で、白血病による症状がなくなる完全寛解(血液学的完全寛解:CR)を 目指します。完全寛解は、顕微鏡で見る限り骨髄中や血液中に白血病細胞がなくなり、造血機能が回復して輸血の必要がない状態のことです。
次の①~⑤をすべて満たした場合には、完全寛解と判断されます。
①形態学的に白血病細胞を認めない
②骨髄中の芽球が5%未満で、アウエル(Auer)小体(骨髄芽球や単芽球の細胞質に見られる針状の物質)陽性の芽球なし
③骨髄外の病変なし
④赤血球輸血の必要がない
⑤末梢血中の好中球数1,000/μL以上、血小板数100,000/μL以上
上記の①~③のみを満たしている場合は、専門的にはCRi(血球数回復が不完全な完全寛解)と呼ばれます。CRiでも治療効果があったと判断して、その薬物療法を継続したり次の治療に進んだりすることがあります。
ただし、CR、CRiでは、血液や骨髄の中に10億個以上の白血病細胞がまだ存在しています。そのため、さらに分子生物学的(分子遺伝学的)完 全寛解(CMR)を目標に、寛解後療法を行います。CMRは遺伝子を調べても白血病細胞が見つからない最も高いレベルの完全寛解で、微小残存病変 (MRD)が陰性になった状態です。MRDが陰性かどうかは、DNA配列の特定の領域を増幅させて原因遺伝子の有無をみるPCR法で判断します。
臨床試験とは?
新しい薬や治療法の人間に対する有効性や安全性について調べるために行われるのが「臨床試験」です。現在、使われている薬や標準治療は、国内外で臨床試験を重ねることで開発され、確立されたものです。
臨床試験には、初期の安全性や薬物動態をみる「第Ⅰ相試験」、少数(多くは数十例)を対象に有効性と安全性をみる「第Ⅱ相試験」、数百人を対象にすでに承認されている薬と新薬の候補、あるいは、標準治療と新治療の候補を比較して有効性と安全性をみる「第Ⅲ相試験」の3段階があります。
臨床試験は医療の発展に不可欠であり、試験への参加は将来の患者さんを助けることになります。また、ある程度よいとわかっている薬や治療法が早く使える利点がある場合もありますが、予期せぬ副作用が出る危険性もあります。臨床試験への参加を検討するときには、試験の段階、目的と方法、利点やリスクをよく確認することが大切です。
◆ある程度強力な薬物療法が可能な人の治療
高齢者、あるいは若年者でも併存疾患などがあって標準的な多剤併用療法の実施は難しいものの、ある程度強力な薬物療法が可能な場合には、抗がん剤の投与量を減量した寛解導入療法を行います。
前述のように、高齢者であっても、可能であれば標準的な多剤併用療法も治療の選択肢の1つになります。
この場合の寛解導入療法では、ダウノルビシン(40㎎/㎡)とシタラビン(100㎎/㎡)、あるいはダウノルビシン(40㎎/㎡)とエノシタビン(商品名サンラビン、200㎎/㎡) の併用療法が推奨されています。
寛解導入療法によって白血病細胞の数が大幅に減少し、完全寛解になった場合には、寛解後療法を行い、その後に可能ならば、同種移植の実施を検討します。同種移植が可能かどうかは、年齢、全身状態、臓器の状態などから慎重に判断します。以前は、65歳以上の高齢者に同種移植をすることはまれでしたが、近年、移植前処置の強度を下げた骨髄非破壊的移植(ミニ移植、「造血幹細胞移植について」参照)が普及し、高齢者でも同種移植を受ける人が増えています。
抗がん剤による寛解導入療法によって完全寛解にならないときには、抗がん剤を変更して再度寛解を目指した救援療法など状況に応 じた治療を行います。
救援療法として、若年者の場合と同様に、分子標的薬(FLT3阻害薬)や抗体薬(ゲムツズマブオゾガマイシン)が選択されることがあります。
◆標準的な多剤併用療法が難しい場合
高齢者、あるいは若年者でも併存疾患があって標準的な多剤併用療法が難しい場合には、ベネトクラクス(商品名ベネクレクスタ)とDNAメチル化阻害薬のアザシチジン(商品名ビターザ、アザシチジン)の併用療法、あるいはベネトクラクスと少量シタラビンの併用療法を行います(図表11)。
ベネトクラクスは、白血病細胞の細胞質内に過剰に発現しているBCL-2タンパク質の 働きを阻害して白血病細胞の死滅を促す分子標的薬の内服薬で、2021年3月に保険適用されました。
従来は、標準的な多剤併用療法が難しい人に対しては有効な治療法がなく、アザシチジンの単独投与などが行われることもありました。75歳以上のAML患者と、75歳未満で標準的な多剤併用療法が難しいAML患者を対象にした臨床試験では、いずれの群でもベネトクラクスとアザシチジン併用療法、あるいはベネトクラクスと少量シタラビンの併用療法の方がアザシチジンの単独投与などより完全寛解に達成する割合が2倍以上高まり、生存期間も延長するとの結果が出ています。
ベネトクラクスとアザシチジンの併用療法では、ベネトクラクスを1日目100㎎、2日目200㎎と増量し、3日目以降は400㎎を毎日1回食後に内服します。アザシチジン (75㎎/㎥)は1日1回7日間皮下注射か点滴投与し、21日間休薬します。
ベネトクラクスとシタラビン少量療法を併用する場合には、ベネトクラクスは1日目 100㎎、2日目200㎎、3日目400㎎と増量し、4日目以降は600㎎を毎日1回食後に内服します。シタラビン(20㎎/㎥)は10日間皮下注射し、18日間休薬します。
どちらの併用療法も28日間を1コースとし、これを繰り返して完全寛解とその維持を目指します。
最初は入院することもありますが、基本的には、外来でできる治療法です。効果が持続している限り、ベネトクラクスとアザシチジン、あるいはベネトクラクスとシタラビンの併用療法を継続します。ベネトクラクスは1日1回食後に服用します。朝食後や夕食後など、毎日同じ時間帯に服用するように習慣づけ、飲み忘れを防ぎましょう。
副作用が強く出た場合には薬を休薬・減量したり、次のコースに入るタイミングを調整したりします。
ベネトクラクスを中心とした治療の効果が得られないようなら、FLT3阻害薬やゲムツズマブオゾガマイシンで治療することもあります。

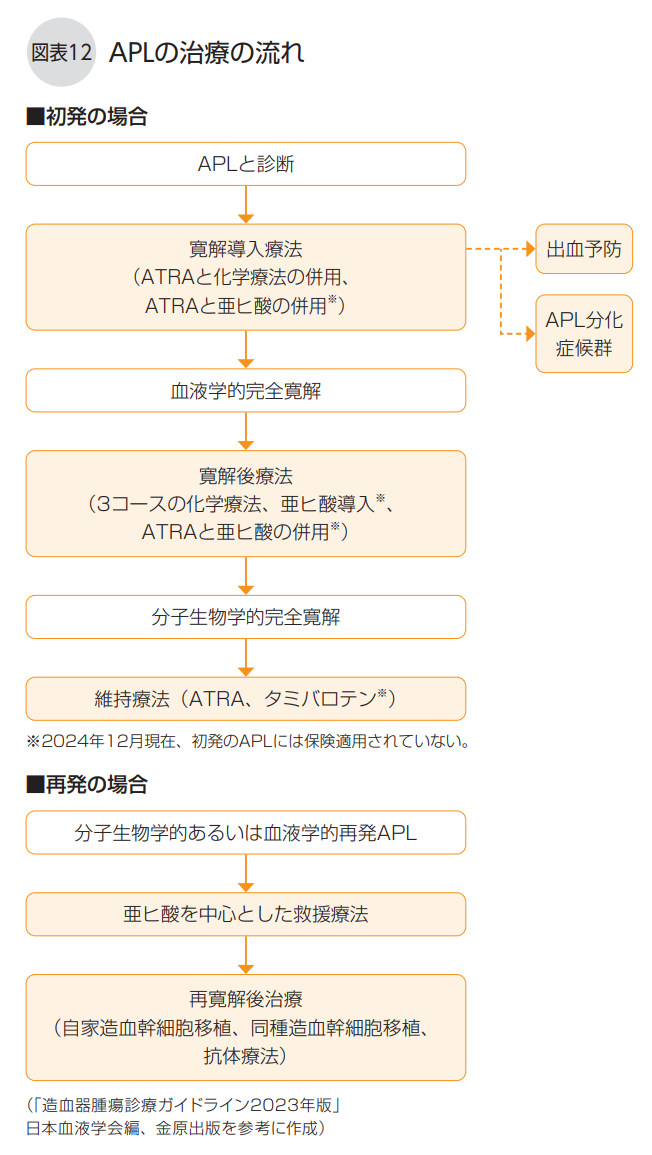
◆急性前骨髄性白血病(APL)の治療
APLは、AMLの10~15%を占め、30~50代の患者さんが多いのが特徴です。治療は他のAMLとは異なります(図表12)。それは、APLの発症原因であるPML::RARA 遺伝子産物に作用する分子標的薬である内服薬トレチノイン(ATRA、商品名ベサノイド) の有効性が証明されているからです。
APLは、全身のあらゆる場所で血液が固まりやすくなる「播種性血管内凝固症候群」(DIC)が起こる病気です。体のさまざまな場所に微小の血栓(血の塊)ができ、それを溶かそうとする体の反応によって脳や肺などの臓器出血が発生しやすくなります。APL の可能性がある場合には、臓器出血などの合併症の発症を抑えるために、染色体・遺伝子検査による確定診断の前にATRAを投与することもあります。
APLの寛解導入療法は、ATRA、アントラサイクリン系抗がん剤(ダウノルビシン、 またはイダルビシン)、シタラビンの併用が基本です。寛解導入療法の効果は高く、90 ~95%程度の人が血液学的完全寛解(上記「完全寛解には種類がある」参照)になります。
APLの寛解導入療法中には、出血を予防するために、血小板の輸血や凍結血漿製剤 用いた補充療法を行うことがあります。また、ATRAの投与中や治療後は、APL分化症候群に注意する必要があります。APL分化症候群の主な症状は、呼吸困難、発熱、体重増加、むくみ、血圧低下などです。APL分化症候群を発症した場合には、できるだけ早期にデキサメタゾン(ステロイド)で治療を開始し、効果が不十分な場合にはATRAを休薬します。
寛解導入療法によって、血液学的完全寛解が得られた場合には、寛解後療法を行います。APLでは、アントラサイクリン系抗がん剤であるイダルビシン、ダウノルビシン、またはミトキサントロン(商品名ノバントロン)のいずれかにシタラビンを併用した寛解後療法を2~3コース行うのが標準的です。
寛解後療法の目標は、骨髄中にPML::RA RA遺伝子を検出しなくなる分子生物学的完 全寛解(上記「完全寛解には種類がある」参照)を達成することです。 治療前の白血球数が10,000/μLを超えていた人は再発リスクが高いので、ATRAまたはタミバロテン(商品名アムノレイク)の内服を中心とした維持療法を検討します。維持療法は、分子生物学的寛解状態を維持し再発を予防するために、一定期間継続して行う治療です。
APLは、ATRA療法の導入以降、AMLの中で最も治癒率の高い病気になりつつありま す。それでも、他のAMLと同じように、定期的に血液検査や骨髄検査を受けて、「分子生物学的再発」や「血液学的再発」が起きていないか経過観察を行う必要があります。
骨髄検査でPML::RARA 遺伝子が見つかった場合には分子生物学的再発とみなされ、 放置すると、白血病化した前骨髄球が増えるため(血液学的再発)、亜ヒ酸(ATO、商品名トリセノックス)を中心とした再寛解導入療法を実施します。亜ヒ酸は注射薬で、入院して、1日1~2時間かけて点滴投与します。 アントラサイクリン系抗がん剤を併用することもあります。
なお、ATRAと亜ヒ酸は、妊娠中、あるいは妊娠の可能性のある女性には使えない薬であり、使用中は避妊が必要です。
再寛解導入療法によって完全寛解になり、骨髄中のPML::RARA 遺伝子が見られなく なったら、患者さん本人の末梢血幹細胞を用いた自家造血幹細胞移植(自家移植、「造血幹細胞移植について」参照)の実施を検討します。骨髄検査でPML::RA RA遺伝子があれば、同種移植の実施を検討します。
年齢や全身状態、臓器の状態などからみて、同種移植が難しい場合には、ゲムツズマブオゾガマイシンによる抗体療法が選択されることがあります。
AYA世代の治療
15歳から30代のAYA(思春期・若年成人、Adolescent and Young Adult)世代は、小児がんと成人がんの境界にあり、進学、就職、学業や仕事の継続、結婚などに関する心理面・ 社会面の支援も重要です。
AMLの治療では生殖能力を失うことがあります。精子や卵子、受精卵の凍結保存など生殖機能温存治療を検討したい人は、治療を開始する前に担当医に相談しましょう。AMLの治療薬は胎児に悪影響を及ぼす恐れがあるため、退院後もしばらくは避妊が勧められます。どのくらい経てば治療薬の影響がなくなるのかは担当医や看護師に確認するとよいでしょう。
セカンドオピニオンとは?
診断や治療方針について担当医から説明された後、さらに情報がほしいときには、別の医師に意見を求める「セカンドオピニオン」を利用する方法があります。
セカンドオピニオンを受けたいときには、担当医に紹介状や検査記録、画像データなどを用意してもらう必要があります。利用にあたっては担当医のファーストオピニオンをまずはしっかり聞くこと、セカンドオピニオンの内容を担当医に伝え、もう一度治療方針についてよく話し合うことが大切です。
セカンドオピニオン外来のある病院の情報は、近隣のがん診療連携拠点病院の相談支援センターで得られます。予約が必要で有料であることが多いので、セカンドオピニオンを受ける病院には事前に受診方法と費用を確認しましょう。
参考資料
もっと知ってほしい急性骨髄性白血病のこと 2024年版, p.9-16































